5 Conservation de l'énergie : premier principe de la thermodynamique
La loi fondamentale qui gouverne le comportement des systèmes thermodynamiques est celle de la conservation de l'énergie, connue sous le nom de premier principe.
Elle s'exprime, pour un système fermé[1], sous la forme suivante : l'énergie contenue dans un système isolé ou qui évolue selon un cycle fermé reste constante, quelles que soient les transformations qu'il subit. Les différentes formes que peut prendre l'énergie d'un système : énergie mécanique, énergie calorifique, énergie potentielle, énergie cinétique... sont ainsi toutes équivalentes entre elles au sens du premier principe. Dans notre cas rappelons-le, seuls la chaleur et le travail seront pris en compte.
Appelant W le travail des forces de pression extérieures et Q la chaleur échangée avec l'environnement et en négligeant les énergies cinétiques mises en jeu, le premier principe peut s'écrire pour un système fermé[1] sous la forme :
 = W + Q
= W + Q
u est une grandeur appelée énergie interne massique du système. C'est une fonction d'état[2] .
Sous cette forme, cette loi est très intuitive et facilement acceptée par les élèves : c'est une loi de conservation qui stipule que l'énergie ne se perd ni se crée, tout comme la masse.
L'énergie interne n'a cependant de sens que si le système est fermé, et demande à être généralisée lorsqu'on s'intéresse à un système cyclique dans lequel entre et/ou d'où sort de la matière.
Le principe du raisonnement consiste à suivre l'évolution d'un volume de contrôle fermé, et à calculer le travail des forces externes qui s'exerce pendant un cycle sur l'ensemble de ses frontières, en distinguant les sections de passage des fluides (A1 et A2 au temps t0, devenant B1 et B2 au temps t0 +
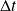 dans la figure ci-dessous), les parois fixes, qui bien évidemment ne produisent ni ne reçoivent aucun travail, et les parois mobiles, au niveau desquelles s'exerce un certain travail
dans la figure ci-dessous), les parois fixes, qui bien évidemment ne produisent ni ne reçoivent aucun travail, et les parois mobiles, au niveau desquelles s'exerce un certain travail
 que l'on appelle travail utile[3].
que l'on appelle travail utile[3].

On peut montrer que, pour des machines cycliques, ce qui est bien le cas de celles qui interviennent dans les cycles que nous étudions, ce travail appelé travail de transvasement, est égal à -
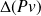 .
.
On a donc W =
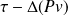
En faisant apparaître une grandeur h appelée enthalpie telle que
 , le premier principe s'écrit, en système ouvert[1] :
, le premier principe s'écrit, en système ouvert[1] :
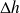 =
=
 + Q
+ Q
La généralisation du premier principe aux systèmes ouverts s'exprime sous la forme suivante : la variation d'enthalpie d'un système ouvert[1] est égale à la somme du travail utile[3] s'exerçant sur les parois mobiles et de la chaleur échangée avec l'extérieur.
L'enthalpie apparaît ainsi simplement comme la généralisation aux systèmes ouverts de l'énergie interne pour les systèmes fermés. Sur le plan pratique, c'est bien ainsi qu'il suffit de considérer cette fonction d'état[2] : il s'agit de l'énergie associée au système considéré, ni plus ni moins.
Notons que dans cette présentation, nous avons commencé par énoncer le premier principe en système fermé[1], considérant que les élèves en avaient déjà entendu parler. Si ce n'est pas le cas, il est possible de directement l'énoncer en système ouvert.
