Convertisseurs électrochimiques
Cinquième module
Nous étudions dans ce module deux types de convertisseurs électrochimiques : les piles à combustible et les électrolyseurs, en construisant progressivement plusieurs modèles de pile, et un seul d'électrolyseur.
L'électrolyse est un procédé ancien et bien connu : un électrolyseur effectue une réaction électrochimique qui produit de l'hydrogène et de l'oxygène à partir de l'eau par consommation d'électricité grâce à une réaction endothermique.
Une pile à combustible effectue la réaction électrochimique inverse : l'hydrogène et l'oxygène réagissent pour produire de l'électricité et de l'eau tout en libérant de la chaleur.
Thème 1 : Piles à combustible
Une pile à combustible réalise une réaction électrochimique inverse de l'électrolyse selon la réaction :
H2 + 1/2 O2 --> H2O
On voit ainsi que si le combustible utilisé est bien de l'hydrogène pur, la pile à combustible a pour seul sous-produit de l'eau : c'est un générateur particulièrement propre.
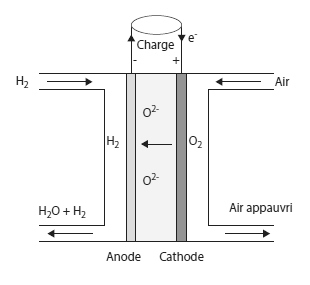
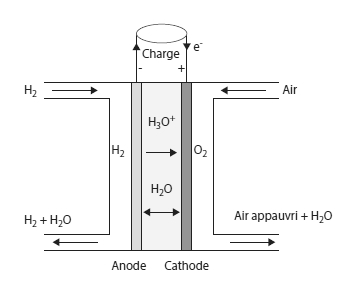
Le cœur de la pile est composé de deux électrodes, l'anode et la cathode, séparées par un électrolyte.
Dans certaines piles, comme les piles à oxydes solides (Solid Oxyde Fuel Cell ou SOFC en anglais), ce sont les ions oxydes O2- qui migrent de la cathode vers l'anode où l'eau est produite.
Dans d'autres piles, comme les piles à membrane échangeuse de protons (Proton Exchange Membrane Fuel Cell ou PEMFC en anglais), ce sont des cations H3O+ (protons H+ hydratés) qui migrent de l'anode vers la cathode.
Texte à trous
Ce texte à trous vous permettra de vérifier votre compréhension du fonctionnement des piles à combustible.
Différents types de piles à combustible
Il existe plusieurs types de piles à combustible, généralement classées selon la nature de leur électrolyte
la pile alcaline AFC (Alkaline Fuel Cell) utilise de la potasse comme électrolyte. Développée pour l’espace ce type de pile est utilisé dans tous les vols habités de la NASA et donne entière satisfaction et est bon marché, mais souffre de la nécessité de ne fonctionner qu'en l'absence de CO2, aujourd'hui produit du reformage. Sa température de fonctionnement est de 80 °C.
la pile PEMFC (Proton Exchange Membrane Fuel Cell) utilise nous l'avons vu, une membrane électrolyte échangeuse de protons. Elle paraît aujourd'hui l'une des plus prometteuses et fait l'objet des plus gros efforts de développement et supplante ainsi la pile alcaline. Elle est susceptible de pouvoir être utilisée pour de nombreuses applications dans toutes les gammes de puissances depuis le watt jusqu’au MW. Son principal handicap est économique, mais des baisses de coût sont espérées à court terme. Sa température de fonctionnement est 80 °C.
la pile PAFC (Phosphoric Acid Fuel Cell) utilise de l'acide phosphorique comme électrolyte. Commercialisée par la société américaine ONSI Corp depuis plusieurs années, elle est surtout intéressante en cogénération compte tenu de sa température de fonctionnement de 200 °C.
la pile MCFC (Molten Carbonate Fuel Cell) utilise des carbonates fondus comme électrolyte. Fonctionnant à haute température (650 °C), le transport ionique est effectué par des ions carbonates. Elle présente l'avantage de pouvoir être directement alimentée avec un gaz de synthèse, et de pouvoir être intégrée dans des cycles complexes à haut rendement en association avec des turbines à gaz.
la pile SOFC (Solid Oxyde Fuel Cell) utilise un oxyde solide (ZrO2) dopé avec de faibles quantités d'oxyde de Calcium et d'oxydes d'ytrium. Son avantage principal est de pouvoir consommer du monoxyde de carbone. Fonctionnant à haute température (600 à 1000 °C),elle peut être intégrée dans des cycles complexes à haut rendement en association avec des turbines à gaz.
Déroulé du cours
Ce cours se présente sous forme d'une série de séances Diapason.
Commencez par la séance introductive :
S60 | 11 | 10 mn 30 s |
Premier modèle
Pour commencer, dans la séance S61, nous étudierons une pile à combustible à oxyde solide à haute température, dite SOFC, alimentée en hydrogène pur, en utilisant un modèle très simple à deux paramètres. Nous montrerons comment établir le bilan des espèces et celui des énergies mises en jeu.
S61 | 16 | 6 mn 20 s |
Modèle avec courbe de polarisation de la pile
Dans la séance S62, le modèle précédent est progressivement affiné, d'abord par la prise en compte de l'équation de polarisation de la pile, puis en introduisant un refroidissement de la pile. Enfin, un exercice montrera comment coupler la pile à une turbine à gaz pour former une installation de cogénération à haut rendement.
S62 | 16 | 8 mn |
Modèle de pile utilisant du méthane
Dans la séance S63, nous voyons comment modifier les modèles établis précédemment pour remplacer l'hydrogène par un combustible comme le méthane.
S63 | 20 | 6 mn 20 s |
Reformage
La séance S64 traite du problème du reformage, c'est-à-dire de la manière de transformer des hydrocarbures en gaz de synthèse permettant d'alimenter en hydrogène la pile à combustible PEMFC étudiée précédemment.
S64 | 34 | 17 mn 40 s |
Modèle de pile PEMFC
La séance S65 montre comment peut être modélisée une pile à combustible à membrane échangeuse de protons à basse température, dite PEMFC.
S65 | 16 | 7 mn 40 s |
Thème 2 : Electrolyseurs
Un électrolyseur réalise une réaction électrochimique qui permet de produire de l'hydrogène et de l'oxygène à partir d'eau grâce à une consommation d'électricité, selon la réaction endothermique :
H2O --> H2 + 1/2 O2
Un électrolyseur est composé de deux électrodes, l'anode et la cathode, séparées par un électrolyte.
Texte à trous
Ce texte à trous vous permettra de vérifier votre compréhension du fonctionnement des électrolyseurs.
Technologies
Les électrolyseurs sont actuellement utilisés pour produire de l'hydrogène pur pour un certain nombre d'industries telles que l'électronique, la pharmacie et l'alimentation. Ils sont cependant chers car ils nécessitent de l'électricité. L'électrolyse produit également de l'oxygène gazeux commercialement précieux qui a de nombreuses applications industrielles. Les technologies varient selon la température de fonctionnement et l'électrolyte.
Le procédé alcalin a été développé en premier et est la méthode la plus mûre de production d'hydrogène, avec l'inconvénient d'avoir de mauvaises performances en raison d'une faible efficacité de conversion et d'une consommation d'énergie élevée.
Récemment, la recherche et le développement se sont concentrés sur les cellules à membrane électrolyte polymère (PEM) utilisant un électrolyte polymère solide qui est plus compact et offre une efficacité et une densité de courant plus élevées.
Cependant, à basse température, les performances des électrolyseurs sont assez faibles en raison des barrières thermodynamiques.
La production d'hydrogène par électrolyse à haute température apparaît comme une voie prometteuse, si bien que de nombreuses recherches sont en cours sur ce sujet, notamment sur les électrolyseurs à cellule d'électrolyse à oxyde solide (SOEC), basés sur la technologie des conducteurs ioniques à oxyde solide, telle que celle utilisée pour les piles à combustible à oxyde solide (SOFC) étudiées dans le premier thème.
Modélisation d'un électrolyseur à haute température
L'électrolyse à haute température (HTE) est un procédé avancé qui effectue la réaction d'électrolyse en phase gazeuse, c'est-à-dire à partir de vapeur, à une température comprise entre 750 °C et 950 °C.
A la sortie de l'électrolyseur, l'hydrogène mélangé à de la vapeur d'eau est collecté. La séparation ne pose pas de problème particulier : il suffit de condenser l'eau pour obtenir de l'hydrogène pur.
Un électrolyseur haute température reçoit un mélange d'eau et d'hydrogène (de composition molaire 80% - 20%) à 30 bar et 800 °C. Il en sort deux fluides : l'oxygène et le mélange initial enrichi en hydrogène.
Le modèle que nous présentons est particulièrement simple : il prend en compte comme paramètres la fraction molaire d'hydrogène en sortie α ou l'électricité fournie ΔH, et le « rendement » en kWh/Nm3, qui exprime la quantité d'électricité à fournir pour électrolyser 1 Nm3 d'hydrogène.
Le bilan des espèces est facile à établir. L'électricité apportée sert à électrolyser l'eau et à produire de l'hydrogène et de l'oxygène, et est convertie pour partie en chaleur qui élève la température de l'appareil.
Le modèle et les résultats auxquels il conduit sont présentés dans le document ci-dessous. Il fait appel aux classes externes EHT et EHToutlet disponibles dans la modélothèque.
Connaissances acquises
Grâce à ce programme, à la fin du module, vous :
aurez étudié divers modèles de piles à combustible, des plus simples ne mettant en jeu que l'hydrogène et l'oxygène à ceux nécessitant le reformage d'un hydrocarbure
connaîtrez les principaux types de piles à combustible
aurez étudié un modèle simple d'électrolyseur à haute température
